|
Senga, Y.*, Akizuki, K.*, Katayama, S., Shigeri, Y., Kameshita, I., Ishida, A., Sueyoshi, N.
*The first two authors contrubuted equally to this work.
'High-performance CaMKI: A highly active and stable form of CaMKIδ produced by high-level soluble expression in Escherichia coli'
Biochem. Biophys. Res. Commun. 475: 277-282, 2016.
「タンパク質の“リン酸化試薬”として有用な高活性型CaMKIの開発」(2016年6月 文責:秋月、末吉)
研究の背景
現在、動物細胞中のタンパク質の1/3以上がリン酸化による制御を受けていると言われている.そのため、タンパク質を幅広くリン酸化できる“リン酸化試薬”としてのプロテインキナーゼは、リン酸化タンパク質の機能解析を行う上で非常に有用なツールとなる[1].しかし、これまでタンパク質の“リン酸化試薬”として、取り扱いが容易でかつ簡単に入手できるものはProtein kinase Aの触媒サブユニット(PKAc)のみであり、基質特異性の異なる別の多機能性プロテインキナーゼについても同様の“試薬”としての開発が強く望まれている.
当研究室では以前、大腸菌での発現を可能にしたCa2+/calmodulin依存性プロテインキナーゼII の活性断片 (CX-30K-CaMKII) を開発したが[2]、不溶性画分にのみ発現することから、精製の際に変性や再生化などの煩雑なステップを要し、簡便には取得できないという問題点があった.そこで本研究では、当研究室で以前ゼブラフィッシュ胚発生過程において重要な役割を担う酵素として同定したCa2+/calmodulin依存性プロテインキナーゼIδ (CaMKIδ)[3]について“リン酸化試薬”としての開発を試みた.
結果・考察
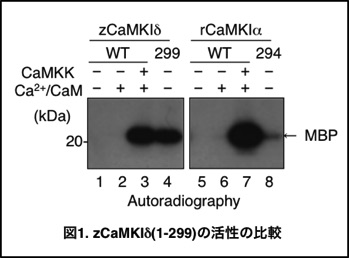 ゼブラフィッシュCaMKIδ(zCaMKIδ)はC末に調節領域が存在していることから、調節領域を欠損させた変異体zCaMKIδ(1-299)を作製した.大腸菌発現系で取得したzCaMKIδ(1-299) は、zCaMKIδ(WT)が必要とするCaMKK(上流キナーゼ)やCalmodulin (CaM)のような活性化因子非存在下で恒常的な活性を示すことがあきらかになった(図1、レーン3, 4).また、興味深いことにCaMKIδと非常に相同性の高いCaMKIαのC末欠損変異体(CaMKIα[1-294])では、活性化したCaMKの活性には到底及ばない微々たる活性しか示さなかった(図1、レーン7, 8).また、CaMKIδ(1-299)はCX-30K-CaMKIIよりも遥かに高い活性を示し、かつ可溶性画分に大量に発現することを明らかにした。実際にCaMKIδ(1-299)の精製を行ったところ、アフィニティーカラムを用いた1ステップの簡便な精製法により、大腸菌培養液1 Lから220 mgと大量に取得できることが明らかになった。次に、CaMKIδ(1-299)の安定性をCX-30K-CaMKIIや既存の“リン酸化試薬”であるPKAcと比較したところ、40°Cの熱処理に対してはCX-30K-CaMKIIとPKAcは失活するのに対し,zCaMKIδ(1-299) は安定して活性を保持した。最後に,比活性及び基質特異性をPKAcと比較したところ、比活性はzCaMKIδ(1-299)の方が5倍ほど高く、PKAcがあまりリン酸化しない塩基性タンパク質をzCaMKIδ(1-299)は好んでリン酸化することが明らかとなった。 ゼブラフィッシュCaMKIδ(zCaMKIδ)はC末に調節領域が存在していることから、調節領域を欠損させた変異体zCaMKIδ(1-299)を作製した.大腸菌発現系で取得したzCaMKIδ(1-299) は、zCaMKIδ(WT)が必要とするCaMKK(上流キナーゼ)やCalmodulin (CaM)のような活性化因子非存在下で恒常的な活性を示すことがあきらかになった(図1、レーン3, 4).また、興味深いことにCaMKIδと非常に相同性の高いCaMKIαのC末欠損変異体(CaMKIα[1-294])では、活性化したCaMKの活性には到底及ばない微々たる活性しか示さなかった(図1、レーン7, 8).また、CaMKIδ(1-299)はCX-30K-CaMKIIよりも遥かに高い活性を示し、かつ可溶性画分に大量に発現することを明らかにした。実際にCaMKIδ(1-299)の精製を行ったところ、アフィニティーカラムを用いた1ステップの簡便な精製法により、大腸菌培養液1 Lから220 mgと大量に取得できることが明らかになった。次に、CaMKIδ(1-299)の安定性をCX-30K-CaMKIIや既存の“リン酸化試薬”であるPKAcと比較したところ、40°Cの熱処理に対してはCX-30K-CaMKIIとPKAcは失活するのに対し,zCaMKIδ(1-299) は安定して活性を保持した。最後に,比活性及び基質特異性をPKAcと比較したところ、比活性はzCaMKIδ(1-299)の方が5倍ほど高く、PKAcがあまりリン酸化しない塩基性タンパク質をzCaMKIδ(1-299)は好んでリン酸化することが明らかとなった。
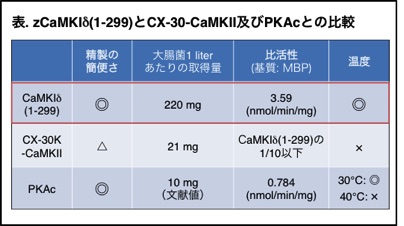 PKAc、CX-30K-CaMKII、zCaMKIδ(1-299)の特徴をまとめたみたところ、本研究で作製したzCaMKIδ(1-299)は、最も簡便かつ大量に精製でき、比活性も安定性も高い、取り扱いやすい“リン酸化試薬”となることが示された(表).また、zCaMKIδ(1-299)はPKAcとは異なる基質をリン酸化できることから、PKAcと相補的に、または組み合わせて用いることでより様々なタンパク質をリン酸化できると考えられる. PKAc、CX-30K-CaMKII、zCaMKIδ(1-299)の特徴をまとめたみたところ、本研究で作製したzCaMKIδ(1-299)は、最も簡便かつ大量に精製でき、比活性も安定性も高い、取り扱いやすい“リン酸化試薬”となることが示された(表).また、zCaMKIδ(1-299)はPKAcとは異なる基質をリン酸化できることから、PKAcと相補的に、または組み合わせて用いることでより様々なタンパク質をリン酸化できると考えられる.
[1] MacKintosh et al. Protein phosphorylation: A practical approach 2nd ed. 153-181, 1999
[2] Shoju et al. J. Biochem. 138: 605-611, 2005
[3] Senga et al. Arch. Biochem. Biophys. 540: 41-52, 2013
|