
酵母遺伝学による膜ストレス応答・修復機構の解析
形質膜は細胞の内と外を隔てる膜であり、細胞を形作る上で必須な構造であり、形質膜の損傷は細胞にとっては極めて重篤なダメージをもたらす。ヒトにおいては激しい運動すると筋細胞は伸縮を繰り返すことにより物理的な膜ストレスに曝されることで常に損傷を受けている。しかし、細胞にはその様な損傷を修復するメカニズムがある。動物細胞ではカベオラと呼ばれる構造が膜損傷の修復に必須な役割を果たすことが分かってきており、カベオラの異常は心筋症の原因であることが知られている。
酵母は単細胞真核生物であり、真核細胞のモデルとしてオートファジーなど様々な細胞内メカニズムの解明に貢献してきた。
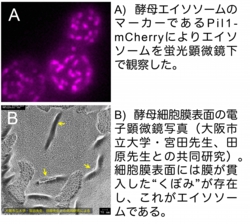
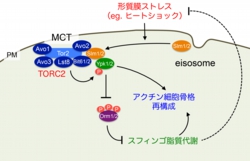
酵母細胞においても膜ストレスを感知・修復するメカニズムは存在しており動物細胞のカベオラに相当するオルガネラとしてエイソソームが知られている。当研究室では、エイソソームが膜ストレス感知に必須なオルガネラであると考え、エイソソームの構造形成および膜修復機構を活性化する下流のシグナル伝達経路(スフィンゴ脂質代謝、アクチン細胞骨格再構成など)に興味を持って研究を行っている。酵母で明らかにされた膜ストレス感知・修復機構がヒトの膜ストレス関連疾患の病態の理解に繋がることが期待される。
1) Audhya et al., EMBO J, 23: 3737-57, 2004.
2) Tabuchi et al., Mol Cell BIol, 15: 5861-75, 2006.
3) Komatsu et al., bioRxiv, 2021, doi.org/10.1101/2021.11.05.467429
3) Ishino et al., FEBS J, 289: 457-472, 2022.
4) Sakata et al., Mol Microbiol, 117(5): 1227-1244, 2022.
酵母発現系を用いた病原菌エフェクターの機能解析
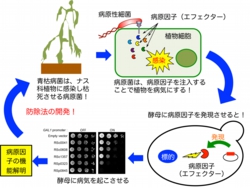
ヒトや植物に感染する多くの病原菌は、宿主(ヒト・植物)に感染する時にⅢ型またはⅣ型分泌装置と呼ばれる構造物を介して宿主細胞中に、病原性に関わるエフェクターと呼ばれるタンパク質を直接注入することが知られている。エフェクターは、宿主細胞内の様々な機能(シグナル伝達、細胞骨格制御、転写、小胞輸送など)を阻害することで、結果的に宿主の生体防御機能を撹乱することで病原菌の感染を成立させている。この様なエフェクターの機能を明らかにすることは、病原菌の宿主への感染戦略を理解する上で重要であり、感染症撲滅を目指した新たな分子創薬のターゲットとしても注目されている。しかし、個々の病原菌は非常に多くのエフェクター分子を有すること(細胞内寄生菌であるクラミジアなどでは、全クラミジアタンパク質の15%以上が宿主細胞に注入されている)、また、エフェクター分子は独自の進化を遂げることで宿主細胞機能の阻害活性を獲得してきたためにタンパク質の一次構造からその機能を予測することが困難であることなどから、ゲノムデータベース上には膨大な数の病原菌ゲノム情報があるにもかかわらず、未だに多くの病原菌エフェクターが機能不明の状態にある。
酵母は、単細胞真核生物であり、多くの細胞機能が動物や植物細胞のそれらと類似している。そして、興味深いことに酵母内において病原菌エフェクターを発現させることにより、動物や植物細胞のカウンターパートに作用することにより、酵母の増殖を阻害することが知られている。例えば、エルシニア菌のエフェクターであるYopEは、動物細胞内において低分子量Gタンパク質であるRhoの機能を阻害することでアクチン細胞骨格を制御することが明らかにされているが、酵母においてYopEを発現させると酵母Rhoタンパク質の機能を阻害することでアクチン細胞骨格の異常とそれに伴う増殖阻害を引き起こすことが明らかにされている。これ以外にも、多くの病原菌エフェクターにおいて同様の例が知られており、酵母は、病原菌エフェクターの機能を解析するシステムとして非常に有用であることが証明されている。
当研究室では、単細胞真核生物である酵母を用いてエフェクターの機能を明らかにするシステムを開発し、本システムを用いてこれまでに青枯病菌と呼ばれる植物病原菌が有するエフェクターの分子機能の解明に取り組んでいる。青枯病菌は、ナス科植物を含む200種以上もの植物に感染、枯死させる病原菌であり、ジャガイモだけでも世界で年間1000億円もの被害が見積もられている。エフェクターの機能の理解により青枯病菌の防除法の開発が期待できる。また、青枯病菌以外に香川県で育種が盛んなキウイフルーツの病害であるかいよう病菌についてもエフェクターの機能解析を行っている。
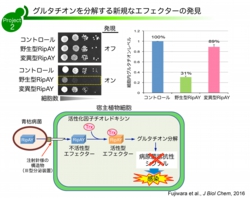
最近、我々の研究室では世界で初めて細胞内のレドックスバッファーとして機能するグルタチオンを特異的に分解する青枯病菌エフェクターRipAYを見出した。また、興味深いことにRipAYは、グルタチオン同様に細胞内のレドックス制御に関わるタンパク質チオレドキシンにより特異的に活性化されることを見出している。植物では、グルタチオンおよびチオレドキシンの阻害は病原菌に対する抵抗性が著しく低下することが知られており、青枯病菌はRipAYを介して宿主レドックスを撹乱することで宿主防除免疫機構を破綻させていることが推測された (1, 2, 3)。
1) 藤原祥子, 田淵光昭, 化学と生物, 54: 869-870, 2016.
2) Popa C., Tabuchi M. and Valls M, Front. Cell. Infect. Microbiol., 6: 73, 2016.
3) Fujiwara S., Kawazoe T., Ohnishi K., Kitagawa T., Popa C., Valls M., Genin S., Nakamura K., Kuramitsu Y., Tanaka N. and Tabuchi M, J. Biol. Chem., 291: 6813-6830, 2016.
4) Fujiwara S.,Ikejiri A., Tanaka N. and Tabuchi M, BBRC., 523: 759-765, 2020.
5) Fujiwara S., Toshio M., Nakayama E., Tanaka N. and Tabuchi M, BBRC, 616: 41-48, 2022
 HOME
HOME
 前のページへ
前のページへ