Contents
研究概要
天然物とは、植物や動物、微生物など様々な生物がつくる二次代謝産物です。この中には、人にとって有用な物質多く発見されています。例えば、農薬、抗生物質、抗がん剤などです。 当研究室では、このような人間にとって有用な天然物の探索から始まり、天然物が 「なぜ活性を示すのか?」 、 「どの構造が活性にとって重要なのか?」 、 「生体内での標的分子は?」 、 「その先に見えてくる生命現象は?」 といったことに興味を持って研究を進めていこうとしています。本研究室では、現在、主に下記3課題の研究を行っています。
抗腫瘍活性を持つジテルペノイドの構造活性相関研究と誘導体設計
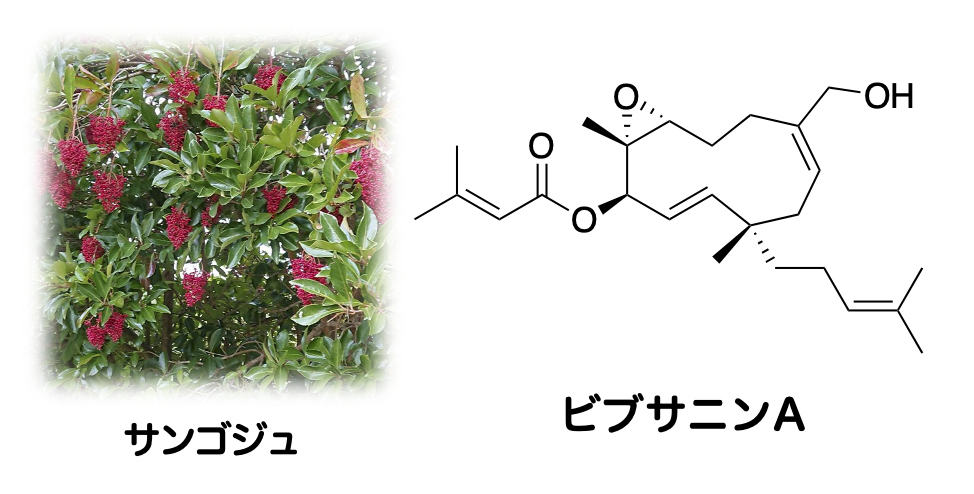
ガマズミ属樹木サンゴジュに含まれるビブサニンAは、抗炎症誘導作用を示すため、プロテインキナーゼCを標的とした医薬品シードとして有望です。タンパク質への詳細な結合様式や構造活性相関については不明な点が多くありました。そこで、植物から抽出したビブサニンAを元に誘導体を合成し活性を評価したり、サンゴジュに含まれるビブサニン類縁体のプロテインキナーゼCリガンドとしての最適化を目指して研究を行っています。
抗がん活性を持つ天然物アナログの設計と合成
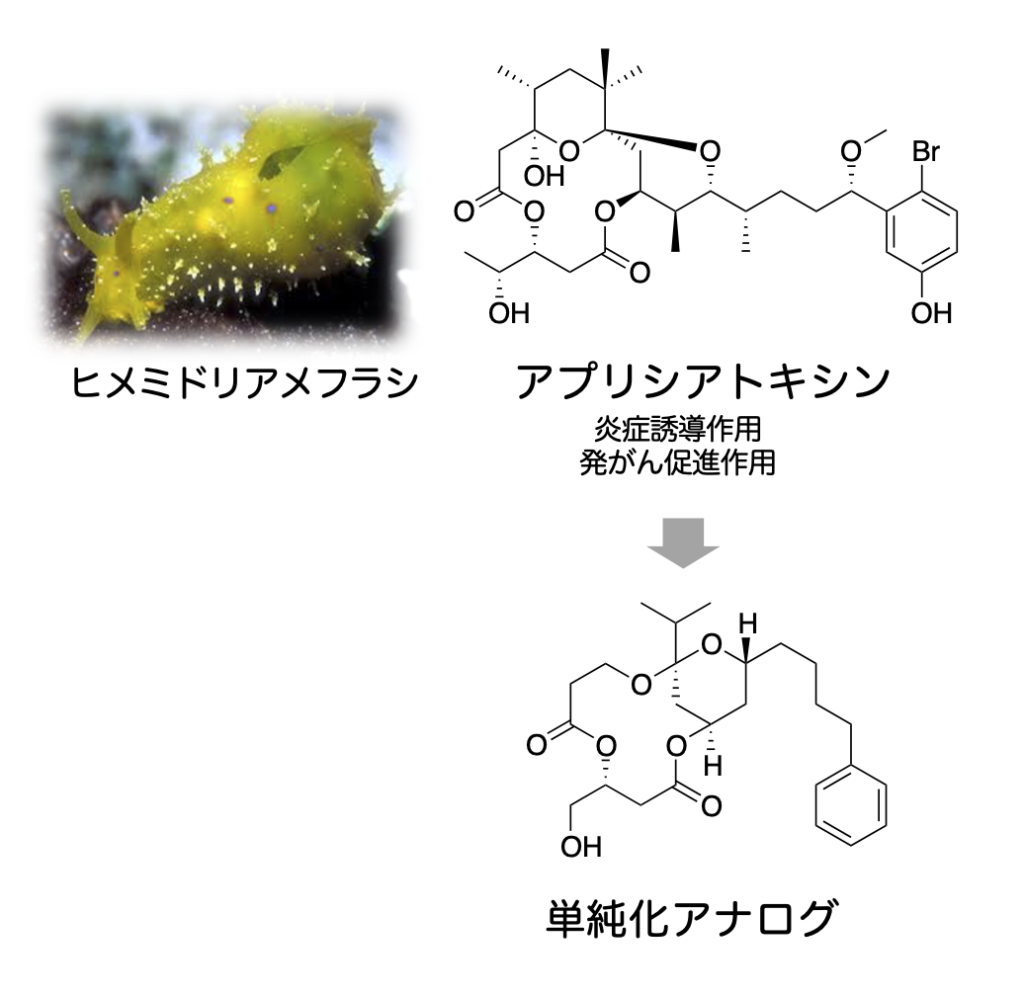
アメフラシから単離されたアプリシアトキシンは、がん細胞増殖抑制活性を持っていますが、同時に強力な炎症誘導作用と発がん促進作用を示します。しかし、その単純化アナログはそういった望ましくない作用を示さないため、抗がん剤シードとして有望です。本研究室ではアプリシアトキシンのスピロケタール部分をより単純な構造に置換したアナログの設計、合成、および活性評価を行っています。
がん細胞の増殖を抑える希少糖の探索と誘導体設計
D-グルコースのC3位のエピマーであるD-アロースはいくつかのヒトがん細胞株に対して増殖抑制効果を示します。しかし、D-アロースやD-プシコースといった一部の希少糖以外については網羅的な活性評価は行われていません。また、単糖である希少糖は一般にミリモーラー以上の比較的高濃度でしか活性を示しません。そこで、希少アルドヘキソースのがん細胞増殖抑制活性のスクリーニングと作用機構解析や、より低濃度でがん細胞増殖抑制活性を示す希少糖誘導体の設計と合成を行っています。
過去の卒論・修論・D論のテーマ
2024年度修論
- 元素置換戦略による新規PKCリガンド骨格の開発 (Takabuchi)
2024年度卒論
- 化学的安定性の高い新規Vibsanin A誘導体の開発 (Kajihara)
- Phorbol esterを単純化した新規PKCリガンドの開発 (Fujita)
- Sinulariol C, Xiguscabrol Aの合成と生物活性評価 (Matsubara)
2023年度修論
- 新規Vibsanin A誘導体の開発および生物活性の評価 (Hatanaka)
- 二環式Vibsanin誘導体の合成と生物活性評価 (Wada)
2023年度卒論
- 3a-Aza-azulene骨格を持つ新規PKCリガンドの開発 (Ishii)
- Azulene骨格を持つ新規PKCリガンドの開発 (Shirai)
- 元素置換戦略を用いた新規PKCリガンドの開発 (Yamaji)
2022年度修論
- 新規希少糖誘導体の合成と生物活性の評価 (Otsuki)
- (R)-(−)-Carvoneを用いたAplysiatoxin単純化アナログの合成と活性評価 (Suzuki)
- アイソザイム選択的なリガンドの創出に向けた天然プロテインキナーゼC活性化剤およびその誘導体の合成と構造活性相関研究 (Sekido)
2022年度卒論
- Allosucroseの合成とα-glucosidase阻害活性評価 (Kato)
- 元素置換戦略による新規プロテインキナーゼCリガンド骨格の開発 (Takabuchi)
- サンゴジュからのVibsanin Aの単離と保護体の合成 (Nakahara)
2021年度修論
- (−)-Carvoneを用いたAplysiatoxin単純化アナログの合成 (Moritoki)
2021年度卒論
- Vibsanin Aと1’-desoxo誘導体の安定性とがん細胞増殖抑制活性の評価 (Hatanaka)
- 希少二糖β-D-allulofuranosyl-α-D-glucopyranosideの合成研究 (Hongawa)
- プロテインキナーゼC結合能を示す新規Vibsanin誘導体の開発 (Wada)
2020年度D論
- Evaluation of Anti-Proliferative Activity of Rare Aldohexoses, and Development of D-Allose Derivatives with Biological Activities (Ishiyama)
2020年度修論
- がん細胞増殖抑制活性を有する非天然および希少リン酸化単糖誘導体の開発 (Kanagawa)
- B環を除去したAplysiatoxin単純化アナログの合成研究 (Yamamoto)
2020年度卒論
- Vibsanin A誘導体の合成とProtein Kinase C結合活性の評価 (Ohtani)
- 非天然型リン酸化単糖の輸送システムの開発 (Ohtsuki)
- PKC結合能を持つAldovibsanin誘導体の設計と合成研究 (Sadano)
2019年度修論
- Thapsigargin単純化アナログの合成研究 (Shimizu)
- 非天然型リン酸化担当の構造活性相関研究 (Yasukawa)
2019年度卒論
- ATXの超単純化アナログの合成と機械学習を利用したスクリーニング (Ogawa)
- サンゴジュからのVibsanin類の単離および誘導体の合成と活性評価 (Nishi)
- 非天然型D-Alloseリン酸化体の合成 (Yamamuro)
2018年度D論
- Prediction of Binding Mode of Aplysiatoxin with Protein Kinase C and Development of a Synthetically-accessible Aplysiatoxin Analog (Ashida)
2018年度修論
- 射干に含まれるイリダール型トリテルペノイドのプロテインキナーゼC結合活性の評価 (Uematsu)
- Thapsigargin単純化アナログの合成研究 (Toyonaga)
2018年度卒論
- 希少糖誘導体ライブラリ構築のためのD-mannoseリン酸化体の網羅的合成 (Kanagawa)
- 希少アルドヘキソースのがん細胞増殖抑制活性の評価 (Kitaguchi)
- B環を除去したAplysiatoxin単純化アナログの合成 (Yamamoto)
2017年度修論
- 希少アルドヘキソースのがん細胞増殖抑制活性 (Takemoto)
2017年度卒論
- RasGRP結合活性を持つThapsigargin単純化アナログの合成 (Kohno)
- サンゴジュに含まれるビブサニン類のプロテインキナーゼC結合活性の評価 (Miyake)
- リン酸化単糖ライブラリの構築を目指したgalactose phosphate類の合成 (Yasukawa)
2016年度修論
- がん細胞増殖抑制活性を示すD-Allose-6-phosphate誘導体の作用機構の解析 (Ishiyama)
- ThapsigarginのC1 domain結合選択性の評価および構造活性相関研究 (Takahashi, C)
2016年度卒論
- ThapsigarginのAB環アナログの合成研究 (Namba)
- 膜透過性D-Glucose-6-phosphate誘導体の合成と生物活性評価 (Toyonaga)
- C1ドメイン結合活性を指標とした新規プロテインキナーゼCリガンドの探索 (Uematsu)
2015年度修論
- AplysiatoxinとプロテインキナーゼC C1ドメインとの結合様式の解明 (Ashida)
2015年度卒論
- 日本産フサコケムシからの新規bryostatin類縁体の探索 (Jinno)
- 膜透過性D-Allose-6-phosphate誘導体の合成とがん細胞増殖抑制活性の評価 (Takemoto)
- AplysiatoxinのプロテインキナーゼC C1ドメイン認識部位の構造活性相関研究 (Fujii)
2014年度修論
- 膜透過性D-Allose-6-phosphate誘導体の合成およびがん細胞増殖抑制活性 (Kobashi)
2014年度卒論
- 膜透過性D-Allose-6-phosphate等価体の合成研究 (Ishiyama)
- AplysiatoxinのProtein kinase C認識部位の構造活性相関研究 (Takahashi, C)
- 日本産フサコケムシからの新規bryostatin類縁体の探索 (Muraki)
2013年度卒論
- Protein kinase C C1ドメインと抗腫瘍性Aplysiatoxin誘導体との結合様式の解明 (Ashida)
- 日本産フサコケムシからの新規bryostatin類縁体の探索 (Takata)
- 膜透過性D-Allose-6-phosphate誘導体の合成に関する研究 (Takahashi, S)
2012年度卒論
- 新規プロテインキナーゼC活性化剤の探索を目指したスクリーニング法の確立 (Kobashi)
- C-6位置換D-Allose誘導体のMOLT-4F白血病細胞に対する増殖抑制効果 (Ogawa)
- D-Allose脂肪酸エステルの側鎖構造の植物生長調節活性における役割 (Yamaashi)